电解池负极是啥化学反应类型
化合反应,水分解了,造成氢气和氧气。水的电解,水(H2O)被直流电源电解法形成氢气和氧气的一个过程被称作水的电解。电流通过水(H2O)时,在阴极根据还原水产生H2(H2),在阳极氧化也可通过空气氧化水产生O2(O2)。H2生成量约是O2两倍。水的电解是替代蒸气重组制氢的下一代制取氢能源方式。
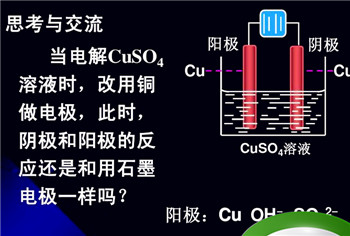
电解池阴极放些与电极材料不相干为什么
由于电解池阴极是电子流出一极,电解质溶液在阴极上了电子,是一个电解质溶液中正离子得电子被还原的化学反应过程。这电子来自电解池外置的电源,所以跟电极材料自身不相干。即便电极材料自身可以和溶液的酸碱性反映,也不会造成危害,由于通电时开关电源传出的电子阻拦电极材料自身的失电子。
如何判断原电池反应和电解池的电级,及其放电顺序
原电池反应
最先剖析所发生的化学反应(电池原理),发生化学反应(即失电子)的一极其负极,产生氧化反应(亦得电子)的一极其正级。
初中化学中原地区充电电池分正负两极,负极一般为金属材料丧失电子,正级一般自身不参加反映,会出现物质在正级获得负极迁移来的电子,有可能是正离子也有可能是分子结构。因此原电池反应并没有离子的放电顺序。
电解池
最先一定要先会分辨两方面,和电源负极连接的是电解池的阴极,和电源正极连接的是电解池的阳极氧化。随后把握阴阳两极的放电顺序。阳极氧化失电子发生化学反应。通称:阳失氧
阴极放电顺序:溶液中的正离子充放电与金属活动性顺序反过来。阴极得电子产生氧化反应。通称:阴得还。
电解反应中生成物的分析——放电顺序
⑴阴极A.阴极原材料(金属或高纯石墨)一直受保护。
B.正离子得电子次序 — 金属活动顺序表反表:
K <Ca2 < Na < Mg2 < Al3 < (H ) < Zn2 < Fe2 < Sn2 < Pb2 < Cu2 < Hg2 < Ag
⑵阳极氧化A.阳极材料是惰性电极(C、Pt、Au、Ti等)时:
阳离子失电子:S2- > I- > Br- > Cl- > OH- > NO3- 等含氧酸根离子 >F-
B.阳极氧化是开朗电级时:电级自身发生氧化反应,溶液中的正离子不充放电。
电解池的氧化还原反应
电解池中,电流量是以阳极氧化流入负极,而电子的流动方向是和电流的方向反过来的,因此是以负极到正级,换句话说,正级获得电子,负极丧失电子,因此电级丧失电子,化合价上升,发生化学反应,归属于氧化剂,顺带给你口决,很可用:阳滋阴还(阳极氧化处理,阴极复原),高失氧(化合价上升失电子氧化还原反应)发生氧化反应氧化剂,低得还(化合价减少得电子氧化反应)被复原氧化物.
二氧化碳阴极反应方程
CO2(二氧化碳)制得C(高纯石墨)的方程式我认识的是Mg CO2=C 2MgO 前提条件是引燃 。 但这个反映不用外置电源,不可以组成电解池,所以也没阴极阳极氧化差别。
非要说有的话就是CO2作阴极(高纯石墨得电子),Mg作阳极氧化(Mg失电子)
阴极反映:CO2 4e-=C 2O2-(数据无法沾到右上方,多多包涵) 阳极反应:2Mg-4e-=2Mg2 阴极阳极反应是胡说的(自己凑的),不是正规的,毕竟反映没法构成电解池因此都找不到靠谱的写法。
阴极放电顺序
电解池电级放电顺序
阴极:正离子充放电,得电子能力很强先充放电
Ag >Hg2 >Fe3 >Cu2 >H >Pb2 >Sn2 >Fe2 >Zn2 > H
(H2O)>Al3 >Mg2 >Na >Ca >K
阳极氧化:阳离子充放电或电级充放电,失电子能力很强先充放电
若阳极氧化是活泼金属(金属活动顺序表Ag之前),溶液中的阳离子一律不充放电,反而是电极材料失电子 。若阳极氧化是可塑性(Pt、Au、高纯石墨),则放电顺序如下所示:
S2->I->Br->Cl- >OH->含氧酸根离子